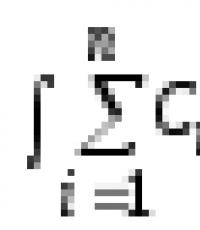Молярная масса двуокиси углерода. Формула углекислого газа структурная химическая
В ней равна +4), называется диоксид углерода (иные названия: углекислый газ, ангидрид угольной кислоты, двуокись углерода). Это вещество принято записывать молекулярной формулой CO2. Молярная масса его равна 44,01 г/моль. По внешнему виду при нормальных условиях угольный ангидрид является бесцветным газом. При низких концентрациях он не имеет запаха, при более высоких концентрациях приобретает острый, кислый запах.
Для этого химического вещества возможны три агрегатных состояния, которые характеризуются различными значениями плотности:
- твердое (сухой лед); при давлении 1 атм. и температуре -78,5 °С — 1562 кг/м³;
- жидкое (углекислота); при давлении 56 атм. и температуре +20 °С — 770 кг/м³;
- газообразное; при давлении 1 атм. и температуре 0 °С — 1,977 кг/м³.
Температура плавления двуокиси углерода равняется -78 °С, температура кипения— -57 °С. Вещество растворяется в воде: при 25 °С и давлении 100 кПа его растворимость равняется 1,45 г/л.
Диоксид углерода является естественным химическим соединением, в молекуле которого атомы кислорода с атомом углерода связаны ковалентной связью. Молекула углекислого газа является линейной и центросимметричной. Обе связи между углеродом и двумя кислородными атомами эквивалентны (по сути являются двойными). Молекула симметрична относительно своего центра, поэтому она не имеет никакого электрического дипольного момента.
Диоксид углерода был одним из первых газообразных химических соединений, которые перестали отождествлять с воздухом. В семнадцатом веке фламандский химик Ян Баптиста ван Гельмонт заметил, что, когда он сжигается уголь в закрытом сосуде, масса полученной золы намного меньше, чем у обычного Свойства двуокиси углерода были изучены более тщательно в 1750 году шотландским врачом Джозефом Блэком.
Диоксид углерода при стандартном давлении и температуре находится в атмосфере Земли в количестве примерно 0,04 % объемных. В рамках углеродного цикла, известного как фотосинтез, двуокись углерода поглощается растениями, водорослями, цианобактериями. В результате образуется вода и углеводы, но происходит этот процесс только под действием света. Углекислый газ также образуется при сжигании угля или углеводородов, при ферментации жидкостей и при выдыхании воздуха людьми и животными. Кроме того, выбрасывается из вулканов, горячих источников, гейзеров.
В диоксид углерода играет важную роль (поглощает и испускает излучение в тепловом инфракрасном диапазоне). Также это химическое соединение является одним из основных источников снижения рН океана: растворяясь в воде, оно образует слабую угольную кислоту: CO2 + H2O ↔ H2CO3, неспособную полностью диссоциировать на ионы.
Углекислый газ не поддерживает горения и дыхания. Зажженная лучина в его атмосфере гаснет. Животные и человек при большой концентрации CO2 задыхаются. При 3 %-ной концентрации в воздухе учащается дыхание, при 10 %-ной наступает потеря сознания и быстрая смерть, а 20 %-ное содержание вызывает мгновенный паралич.
Диоксид углерода является ангидридом угольной кислоты, поэтому для него характерны свойства кислотного оксида. В лабораторных условиях его получают при взаимодействии мела с соляной кислотой в CaCO3 + 2HCl → CaCl2 + CO2 + H2O. В промышленности его производят термическим разложением известняка или мела (реже магнезита или доломита): CaCO3 → CaO + CO2. Получение углекислоты является побочным процессом низкотемпературного разделения воздуха на азот и кислород. В наше время выпускаются специальные генераторы для получения углекислого газа из воздуха. Применяются такие генераторы для подачи CO2 в теплицы с целью создания благоприятной среды для растений.
Диоксид углерода имеет широкое применение в химических производствах. Его используют для получения соды, для синтеза органических кислот, для изготовления безалкогольных напитков. используется как холодильный агент, например, в виноделии. Углекислотная атмосфера создается для предотвращения гниения пищевых продуктов, того же винограда после его сбора и до начала производства вина.
Производство углекислоты или сжиженного углекислого газа осуществляется для заполнения им которые используются для тушения возгораний. Однако им нельзя тушить человека, так значительная часть струи жидкого CO2 испаряется, при этом температура резко понижается (что может вызвать обморожение) и CO2 превращается в сухой лед. Углекислотой обычно тушат и электропроводку. Механизм заключается в прекращении поступления доступа кислорода воздуха к очагу возгорания.
Диоксид углерода, оксид углерода, углекислота – все эти названия одного вещества, известного нам, как углекислый газ. Так какими же свойствами обладает этот газ, и каковы области его применения?
Углекислый газ и его физические свойства
Углекислый газ состоит из углерода и кислорода. Формула углекислого газа выглядит так – CO₂. В природе он образуется при сжигании или гниении органических веществ. В воздухе и минеральных источниках содержание газа также достаточно велико. кроме того люди и животные также выделяют диоксид углерода при выдыхании.

Рис. 1. Молекула углекислого газа.
Диоксид углерода является абсолютно бесцветным газом, его невозможно увидеть. Также он не имеет и запаха. Однако при его большой концентрации у человека может развиться гиперкапния, то есть удушье. Недостаток углекислого газа также может причинить проблемы со здоровьем. В результате недостатка это газа может развиться обратное состояние к удушью – гипокапния.
Если поместить углекислый газ в условия низкой температуры, то при -72 градусах он кристаллизуется и становится похож на снег. Поэтому углекислый газ в твердом состоянии называют «сухой снег».

Рис. 2. Сухой снег – углекислый газ.
Углекислый газ плотнее воздуха в 1,5 раза. Его плотность составляет 1,98 кг/м³ Химическая связь в молекуле углекислого газа ковалентная полярная. Полярной она является из-за того, что у кислорода больше значение электроотрицательности.
Важным понятием при изучении веществ является молекулярная и молярная масса. Молярная масса углекислого газа равна 44. Это число формируется из суммы относительных атомных масс атомов, входящих в состав молекулы. Значения относительных атомных масс берутся из таблицы Д.И. Менделеева и округляются до целых чисел. Соответственно, молярная масса CO₂ = 12+2*16.
Чтобы вычислить массовые доли элементов в углекислом газе необходимо следовать формулерасчета массовых долей каждого химического элемента в веществе.
n
– число атомов или молекул.
Ar
– относительная атомная масса химического элемента.
Mr
– относительная молекулярная масса вещества.
Рассчитаем относительную молекулярную массу углекислого газа.
Mr(CO₂) = 14 + 16 * 2 = 44 w(C) = 1 * 12 / 44 = 0,27 или 27 % Так как в формулу углекислого газа входит два атома кислорода, то n = 2 w(O) = 2 * 16 / 44 = 0,73 или 73 %
Ответ: w(C) = 0,27 или 27 %; w(O) = 0,73 или 73 %
Химические и биологические свойства углекислого газа
Углекислый газ обладает кислотными свойствами, так как является кислотным оксидом, и при растворении в воде образует угольную кислоту:
CO₂+H₂O=H₂CO₃
Вступает в реакцию со щелочами, в результате чего образуются карбонаты и гидрокарбонаты. Этот газ не подвержен горению. В нем горят только некоторые активные металлы, например, магний.
При нагревании углекислый газ распадается на угарный газ и кислород:
2CO₃=2CO+O₃.
Как и другие кислотные оксиды, данный газ легко вступает в реакцию с другими оксидами:
СaO+Co₃=CaCO₃.
Углекислый газ входит в состав всех органических веществ. Круговорот этого газа в природе осуществляется с помощью продуцентов, консументов и редуцентов. В процессе жизнедеятельности человек вырабатывает примерно 1 кг углекислого газа в сутки. При вдохе мы получаем кислород, однако в этот момент в альвеолах образуется углекислый газ. В этот момент происходит обмен: кислород попадает в кровь, а углекислый газ выходит наружу.
Получение углекислого газа происходит при производстве алкоголя. Также этот газ является побочным продуктом при получении азота, кислорода и аргона. Применение углекислого газа необходимо в пищевой промышленности, где углекислый газ выступает в качестве консерванта, а также углекислый газ в виде жидкости содержится в огнетушителях.
Энциклопедичный YouTube
-
1 / 5
Оксид углерода(IV) не поддерживает горения . В нём горят только некоторые активные металлы: :
2 M g + C O 2 → 2 M g O + C {\displaystyle {\mathsf {2Mg+CO_{2}\rightarrow 2MgO+C}}}Взаимодействие с оксидом активного металла:
C a O + C O 2 → C a C O 3 {\displaystyle {\mathsf {CaO+CO_{2}\rightarrow CaCO_{3}}}}При растворении в воде образует угольную кислоту :
C O 2 + H 2 O ⇄ H 2 C O 3 {\displaystyle {\mathsf {CO_{2}+H_{2}O\rightleftarrows H_{2}CO_{3}}}}Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов:
C a (O H) 2 + C O 2 → C a C O 3 ↓ + H 2 O {\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\rightarrow CaCO_{3}\downarrow +H_{2}O}}} (качественная реакция на углекислый газ) K O H + C O 2 → K H C O 3 {\displaystyle {\mathsf {KOH+CO_{2}\rightarrow KHCO_{3}}}}Биологические
Организм человека выделяет приблизительно 1 кг (2,3 фунта) углекислого газа в сутки .
Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, и уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он .
Углекислый газ (CO 2) транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина , а не с гемом . Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот - связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там.
Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором . Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма - вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину , что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты).
Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз , в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза .
Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае аварийной разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё - делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде .
Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 40 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк , доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина , который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона .
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора , мела или соды с соляной кислотой , используя, например, аппарат Киппа . Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель , обозначается на упаковке кодом Е290 .
Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях . Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими .
Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги . При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений
Углекислый газ используется для газирования лимонада и газированной воды . Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его распад с выделением кислорода. Выделяющийся кислород окисляет металл . В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний . Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде.
Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,- таким образом, работа с подобными баллонами может считаться вполне безопасной.
Твёрдая углекислота - «сухой лёд» - используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки .
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях - анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO 2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта . Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем . Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф . Для измерения низких концентраций CO 2 (а также ) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе .
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40-70°) широт Северного полушария.
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы : Венеры , Марса .
Токсичность
Углекислый газ нетоксичен, но по воздействию его повышенных концентраций в воздухе на воздуходышащие живые организмы его относят к удушающим газам (англ.) русск. . Незначительные повышения концентрации до 2-4 % в помещениях приводят к развитию у людей сонливости и слабости. Опасными концентрациями считаются уровни около 7-10 %, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), в зависимости от концентрации, в течение времени от нескольких минут до одного часа. При вдыхании воздуха с высокими концентрациями газа смерть наступает очень быстро от удушья .
Хотя, фактически, даже концентрация 5-7 % CO 2 не смертельна, уже при концентрации 0,1 % (такое содержание углекислого газа наблюдается в воздухе мегаполисов) люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоких содержаниях кислорода большая концентрация CO 2 сильно влияет на самочувствие.
Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья и после удаления пострадавшего из загазованной атмосферы быстро наступает полное восстановление здоровья .
Оксид углерода(IV) (углекислый газ , диоксид углерода , двуокись углерода , угольный ангидрид ) - CO 2 , бесцветный газ (в нормальных условиях), без запаха, со слегка кисловатым вкусом .
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,0395 %.
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк , доломит) или при производстве алкоголя. Смесь полученных газов, промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната, чаще применяется водный раствор моноэтаноламина , который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его, таким образом, отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона .
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора , мела или соды с соляной кислотой . Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290 .
Жидкая углекислота широко применяется в системах пожаротушения , в огнетушителях и для производства газированной воды и лимонада .
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Когда углекислота применяется в газовой фазе, то для хранения она используется под давлением, как сжиженный газ, в виде жидкой фазы. Хранение углекислоты в баллоне в сжиженном состоянии намного выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31°С. Когда в 40-литровый баллон с нормальным давлением 100 кгс/сm² залито 30 кг сжиженного углекислого газа, то при температуре 31°С в баллоне будет только жидкая фаза с давлением 100 кгс/сm². Если температура будет выше, то следует уменьшить заполнение баллона или использовать баллоны с более высоким рабочим давлением. Если углекислота будет охлаждаться, то при температуре 21°С при нормальном заполнении в баллоне появиться газовая фаза.
Твёрдая углекислота - «сухой лёд» - используется в качестве хладагента в лабораторных исследованиях, в розничной торговле и т.д.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях - анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO 2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта . Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем . Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф .
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40-70°) широт Северного полушария.
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность
Углекислый газ является тяжелым, по сравнению с воздухом, газом без цвета и запаха. Воздействие его повышенных концентраций на живые организмы относит его к удушающим газам (англ.) русск. . Незначительные повышения концентрации до 2-4% в непроветриваемых помещениях приводят к развитию сонливости и слабости. Опасными концентрациями считаются уровни 7-10%, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потери сознания в течение периода времени от нескольких минут до одного часа. Отравление этим газом не приводит к долговременным последствиям и после его завершения происходит полное восстановление организма.
См. также
Примечания
Литература
- Вукалович М.П., Алтунин В.В., Теплофизические свойства двуокиси углерода, Атомиздат, Москва, 1965. 456 с.
- Тезиков А.Д., Производство и применение сухого льда, Госторгиздат, Москва, 1960. 86 с.
- Гродник М.Г., Величанский А.Я., Проектирование и эксплуатация углеслотных установок, ″Пищевая промышленность″, Москва, 1966. 275 с.
- Талянкер Ю.Е., Особенности хранения баллонов со сжиженным газом, Журнал "Сварочное производство", №11, 1972, Москва.
Ссылки
- International Chemical Safety Card 0021 (англ.)
- CID 280 с сайта PubChem (англ.)
- CO 2 Диоксид углерода, свойства, применение (англ.)
- Фазовая диаграмма (давление-температура)для диоксида углерода
- Molview from bluerhinos.co.uk Диоксид углерода в 3D
- Dry Ice information (англ.)
Пищевая добавка Е290 (диоксид углерода) применяется в пищевой промышленности в роли консерванта, регулятора кислотности и антиоксиданта. В быту добавка Е290 больше известна, как углекислый газ.
По своим физическим свойствам диоксид углерода является бесцветным газом, не имеющим запаха и обладающим немного кисловатым вкусом. Добавка Е290 может растворяться в воде с образованием слабой угольной кислоты. Химическая формула диоксида углерода: CO 2 .
В промышленных масштабах углекислый газ получают из дымовых газов путем его абсорбирования карбонатом калия или моноэтаноламина. Для этого смесь промышленных газов пропускают через раствор карбоната калия. Диоксид углерода абсорбируется данным раствором, образуя гидрокарбонат. Далее раствор гидрокарбоната нагревают или подвергают пониженному давлению, в результате чего из него высвобождается чистая углекислота.
Кроме этого, диоксид углерода могут получать на специальных установках по разделению воздуха, как побочный продукт при добыче чистого кислорода, аргона и азота.
В небольших количествах в лабораторных условиях диоксид углерода получают путем взаимодействия карбонатов с кислотами. Например, в ходе реакции мела с соляной кислотой происходит образование нестабильной угольной кислоты с последующим ее распадом на углекислый газ и воду:
- СаСО 3 + 2НСl = СаСl 2 + СО 2 + Н 2 О
Диоксид углерода входит в состав атмосферы и многих живых клеток нашего организма. По этой причине добавку Е290 можно отнести к классу относительно безвредных пищевых добавок.
Однако, следует помнить, что углекислый газ способствует ускоренному всасыванию различных веществ в слизистую желудка. Именно этот эффект проявляется при быстром опьянении в результате употребления газированных алкогольных напитков.
Кроме этого, газированные напитки представляют собой не что иное, как слабую угольную кислоту. Поэтому чрезмерное употребление напитков с добавкой Е290 противопоказано людям с болезнями желудка и желудочно-кишечного тракта (язвы, гастриты).
Существуют и более безобидные «побочные эффекты» воздействия углекислоты на организм. Так, при употреблении газированных напитков, у большинства людей наблюдается отрыжка и «вздутие живота».
Бытует и еще одно мнение относительно вреда пищевой добавки Е290. Сильногазированные напитки могут способствовать «вымыванию» кальция из костей организма.
В пищевой промышленности диоксид углерода применяется в качестве добавки-консерванта Е290 при производстве алкогольных и безалкогольных напитков. Угольная кислота, образуемая при реакции диоксида углерода с водой обладает обеззараживающим и антимикробным действием.
В хлебопекарном деле добавка Е290 может применяться в качестве разрыхлителя, придавая пышность хлебобулочным изделиям.
Диоксид углерода широко применяется и при производстве винной продукции. Регулируя количество углекислого газа в вином сусле можно управлять брожением.
Также оксид углерода может применяться в роли защитного газа при хранении и транспортировки различных пищевых продуктов.
Другие направления использования диоксида углерода:
- в сварочном производстве в качестве защитной атмосферы;
- в холодильных установках в виде «сухого льда»;
- в системах пожаротушения
- в газобалонной пневматике
Добавка Е290 разрешена для использования в пищевой промышленности практически всех стран мира, в том числе Украине и РФ.