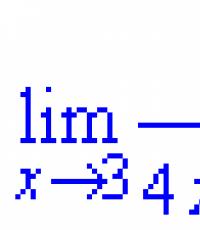Примеры реакций нуклеофильного присоединения. Реакция электрофильного присоединения включает несколько стадий Образование ϭ- комплекса или карбкатиона
Молекула этанола не является достаточно активным нуклеофилом для этой реакции. Чтобы увеличить активность электрофильного центра (карбонильный углерод с δ+) и используют кислотный катализ. На первой стадии реакции альдегид (1) взаимодействует с хлороводородом по основному центру (атом кислорода с неподеленной электронной парой), образуя катион, который существует в виде двух резонансных структур (2 и 3). В карбкатионе (3) на электрофильном центре уже полный положительный заряд (а не частичный, как в исходном альдегиде). Таким образом, активность электрофильного центра увеличилась, и он может взаимодействовать со слабым нуклеофилом – молекулой спирта. Новая связь C-O образуется за счет неподеленной электронной пары кислорода, поэтому на нем появляется положительный заряд (4). Для стабилизации этому катиону необходимо отщепить протон водорода. Его принимает анион Cl - . Образуется молекула конечного продукта реакции – полуацеталя.
По такому же механизму происходит дальнейшее превращение полуацеталя в ацеталь:
 |
Эти реакции обратимы, в кислой среде полуацетали и ацетали гидролизуются до соответствующих альдегидов и спиртов. Вот почему катализатором в реакциях их образования является газообразный хлороводород, а не его водный раствор.
Реакцию образования ацеталей часто используют в органическом синтезе для защиты альдегидной группы от окисления. После проведения реакции окисления защиту «снимают», т.е. проводят кислотный гидролиз.
Кетоны в реакцию со спиртами практически не вступают.
 Присоединение синильной кислоты HCN.
Эта реакция характерна и для альдегидов, и для кетонов. Рассмотрим её на примере ацетона.
Присоединение синильной кислоты HCN.
Эта реакция характерна и для альдегидов, и для кетонов. Рассмотрим её на примере ацетона.
Реакция протекает в присутствии щелочи в качестве катализатора.
Синильная кислота – слабая кислота, с малой степенью диссоциации, т.е. плохой источник нуклеофилных частиц (цианид-анионов CN -). Для активизации нуклеофила и используют катализатор:
![]()
 Далее реакция протекает по общему механизму нуклеофильного присоединения:
Далее реакция протекает по общему механизму нуклеофильного присоединения:
Нуклеофил атакует электрофильный центр молекулы ацетона, π-связь C=O разрывается гетеролитически, оба ее электрона уходят к атому кислорода, поэтому там появляется отрицательный заряд (1), новая связь C-C образуется за счет электронов нуклеофила. Анион (1) присоединяет протон водорода от молекулы воды, образуя оксинитрил (2) и гидроксид-анион, что доказывает, что щелочь являлась катализатором этой реакции.
Циангидрины способны к гидролизу с образованием соответствующих оксосоединений и синильной кислоты. Некоторые циангидриды встречаются в природе (синтезируются растениями). Употребление их в пищу (косточки сливы, вишни, горького миндаля) может привести к отравлению.
 Присоединение воды.
Эта реакция обратима. Её равновесие контролируется стерическими и электронными факторами.
Присоединение воды.
Эта реакция обратима. Её равновесие контролируется стерическими и электронными факторами.
Гидраты большинства альдегидов и особенно кетонов неустойчивы, существуют только в растворах. Гидрат трихлоруксусного альдегида (хлораля) очень устойчив, что связано с электроноакцепторным действием атомов хлора:
 Восстановление кетонов приводит к получению вторичных спиртов, например:
Восстановление кетонов приводит к получению вторичных спиртов, например:
Взаимодействие с аммиаком и аминами. Амины и их производные типа X-NH 2 реагируют с альдегидами и кетонами в две стадии. Сначала протекает реакция нуклеофильного присоединения, продукты которой неустойчивы и отщепляют молекулу воды. Поэтому такие реакции характеризуют как присоединение-отщепление .
 Рассмотрим механизм реакции на примере взаимодействия ацетальдегида с аммиаком.
Рассмотрим механизм реакции на примере взаимодействия ацетальдегида с аммиаком.
Имины называют также основаниями Шиффа.
Имины являются промежуточными продуктами во многих ферментативных процессах, например, в биосинтезе
α-аминокислот в организме.
Основания Шиффа легко гидролизуются водными растворами минеральных кислот с образованием исходных продуктов. В организме гидролиз иминов происходит в процессе окислительного дезаминирования α-аминокислот.
Помимо аммиака, в реакцию просоединения-отщепления с альдегидами и кетонами вступают первичные амины (R-NH 2), гидроксиламин (NH 2 -OH), гидразин (NH 2 -NH 2), фенилгидразин (C 6 H 5 -NH-NH 2), семикарбазид (NH 2 -NH-CO-NH 2):
 |
Все эти производные – кристаллические соединения с чёткими температурами плавления, поэтому их получение может использоваться для идентификации альдегидов и кетонов. А так как эти производные так же, как и имины способны к гидролизу с образованием исходных соединений, то данные реакции могут использоваться и для выделения оксосоединений из смесей с другими соединениями.
Через стадию образования альдимина при взаимодействии пиридоксальфосфата (см. стр. 195) и α-аминокислоты протекает реакция переаминирования белковых α-аминокислот (основной путь биосинтеза α-аминокислот).
Реакция альдольной конденсации характерна только для альдегидов, в структуре которых есть α-CH-кислотный центр. Реакция катализируется щелочами.
 |
Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углерод-углеродной связи, при этом из двух или более относительно простых молекул образуется новая более сложная молекула.
 Эта реакция начинается по CH-кислотному центру альдегида:
Эта реакция начинается по CH-кислотному центру альдегида:
Образующийся анион CH-кислоты стабилизирован за счёт p,π-сопряжения. Он является нуклеофилом по отношению к другой молекуле альдегида, и далее реакция протекает по общему механизму нуклеофильного присоединения:
В результате реакции образуется соединение, являющееся альд егидом и спиртом (алкоголь ) – альдоль.
Альдольная конденсация имеет место и в биологических системах. Например, биосинтез лимонной кислоты, нейраминовой кислоты протекает по механизму альдольной конденсации.
Те альдегиды, которые не имеют атомов водорода при α-углеродном атоме, т.е. не проявляют CH-кислотных свойств, в присутствии щелочей реагируют по-иному. Для них характерна реакция Канниццаро. Другое название этой реакции – диспропорционирование, или реакция оксидоредукции: одна молекула альдегида при этом окисляется, а другая – восстанавливается.
Реакция Канниццаро характерна, например, для бензальдегида:
В случае формальдегида реакция Канниццаро протекает в водном растворе без катализатора:
 |
В водных растворах формальдегида накапливается муравьиная кислота, поэтому эти растворы имеют кислую реакцию.
 За счёт CH-кислотного центра протекают также реакции галогенирования
, например, так называемая иодоформная реакция:
За счёт CH-кислотного центра протекают также реакции галогенирования
, например, так называемая иодоформная реакция:
Эту реакцию дают все оксосоединения, в структуре которых есть группа
Т.е. уксусный альдегид и все метилкетоны (ацетон, метилэтилкетон, метилпропилкетон и т.п.). Образующийся иодоформ обладает характерным «аптечным» запахом, а при достаточной концентрации выпадает в виде желтоватого осадка.
Иодоформную реакцию используют как качественную, чтобы отличить уксусный альдегид от всех других альдегидов. В медицинской практике иодоформную реакцию используют для обнаружения ацетона в моче больных сахарным диабетом.
Реакции окисления альдегидов . Альдегиды окисляются очень легко. Даже такие слабые окислители, как аммиачный раствор гидроксида серебра (реактив Толленса) и гидроксид меди (II), окисляют альдегиды в соответствующие карбоновые кислоты. Обе эти реакции используют как качественные для обнаружения альдегидной группы.
 |
||
 |
а) Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.
Полуацеталями называют соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (OR) группы. Ацетали - это соединения, содержащие при одном атоме углерода две алкоксильные группы:
полуацеталь ацеталь
Реакцию получения ацеталей широко используют в органических синтезах для "защиты" активной альдегидной группы от нежелательных реакций:

Особенно важное значение подобные реакции имеют в химии углеводов.
б) Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется:
R-CH=O + NaHSO 3 → R-CH(OH)-SO 3 Na.
в) реакция с теолами . альдегиды и кетоны взаимодействуют с тиолами в кислой среде, образуется дитиоацеталь:
Г) Присоединение циановодородной (синильной) кислоты:
СН 3 -СН=О + H-CN → СН 3 -СН(СN)-ОН.
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используются для удлинения углеродной цепи.
д) Присоединение реактива Гриньяра . В органическом синтезе чрезвычайно часто используется реактив Гриньяра - одно из простейших металлоорганических соединений.
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
R-X + Mg → R-Mg-X ,
где R - алкильный или арильный радикал, X - галоген.
- Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой
Н 2 СО + RMgX → R-CH 2 -O-MgX → R-CH 2 -OH .
- При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:

- Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты :
(СН 3) 2 С=O + R-MgX → (СН 3) 2 С(R)-O-MgX → (СН 3) 2 С(R)-OH
16. Альдегиды и кетоны. Химические свойства: реакция конденсации, реакции с азотсодержащими соединениями. Отдельные представители и их применение.
Органические соединения, в молекуле которых имеется карбонильная группа С=О, называются карбонильными соединениями или оксосоединениями. Они делятся на две родственные группы - альдегиды и квтоны.
Реакция конденсации:
Альдольная конденсация
с соединениями обладающими СН кислотными свойствами альдегиды и кетоны способны вступать в различные реакции конденсации. соединения содержащие подвижный водород в этих реакциях выступает в качестве нуклеофильного реагента и называется мителеновой компонентой, а альдегиды и кетоны называются карбонильной компонентой. реакция альдольной конденсации протекает при действии на альдегид или кетон разбавленных щелочей. при этом одна молекула альдегида представляет собой метиленовую компоненту, другая карбоновую компоненту.
При действии основания альдегид отщепляет протон от α СН кислотного центра и превращается в карбанион. карбанион является сильным нуклеофилом и присоединяется к другой молекуле альдегида. стабилизация образующегося аниона происходит за счет отщепления протона от слабой кислоты.
Механизм:
Если альдольная конденсация сопровождается отщеплением воды (при высокой температуре), то такая конденсация называется кротоновой конденсацией:
Реакцию альдольной или кратоновой конденсации часто проводят в смешанном веществе. когда метеленовая и карбоновая компоненты – это разные соединения. подбор партнеров для этой реакции производят исходя из того, что карбониловая компонента должна обладать высокой реакционной способностью в реакциях нуклеофильного присоединения. в основном это альдегид. в тоже время метиленовая компонента должна обладать высокой СН-кислотностью – различные альдегиды или кетоны, имеющие α-атом водорода.
Имеем реагент НХ, который распадается
Атакует нуклеофильная частица, образуя анион.
Затем идет быстрое присоединение к аниону положительно-заряженной частицы Н + , образуется продукт реакции.
Электроноакцепторные заместители, оттягивая на себя электронную плотность, увеличивают атома углерода и скорость протекания реакции. Поэтому хлоруксусный альдегид активнее чем уксусный.
|
У кетонов, в отличии от альдегидов, с кетонной группой связаны два радикала, понижающие активность молекулы. Поэтому кетоны обладают меньшей активностью, чем альдегиды. Арилы еще более сильные электронодоноры, поэтому ароматические альдегиды и кетоны менее активны, чем алифатические. Карбонильные соединения можно расположить в ряд по уменьшению активности:
На реакционную способоность карбонильной группы влияет и размер радикала, так как при большом размере R затрудняется доступ реагента к атому углерода:
На основе механизма приведем примеры реакций нуклеофильного присоединения:
Присоединение водорода. Из альдегидов получаются первичные спирты, а из кетонов – вторичные:
Присоединение цианводорода (НСN). При этом получаются циангидрины (гидроксинитрилы):
Присоединение гидросульфита натрия (NаНSО 3), при этом получаются гидросульфитные соединения:
Эти вещества легко разлагаются при нагревании с разбавленными кислотами с выделением в чистом виде альдегидов и кетонов.
Присоединение магнийорганических соединений (МОС) (Реактив Гриньяра):
Вывод: из муравьиного альдегида и любого МОС получаются первичные спирты , из других альдегидов и любого МОС – вторичные спирты , а из кетонов и любого МОС – третичные спирты . Для того, чтобы получить, например, бутанол-1 – первичный спирт СН 3 – СН 2 – СН 2 – СН 2 ОН , необходимо взять муравьиный альдегид и СН 3 – СН 2 – СН 2 – MgJ .
1. Реакции нуклеофильного присоединения. Гетеролитические реакции с участием π-связи углерод-кислород (альдегиды, кетоны). Реакции карбонильных соединений с водой, спиртами, тиолами, первичными аминами. Роль кислотного катализа. Гидролиз ацеталей и иминов. Реакции альдольного присоединения, расщепления. Биологическое значение этих процессов.
Для альдегидов и кетонов наиболее характерны реакции нуклеофильного присоединения A N .
Общее описание механизма нуклеофильного присоединения A N
Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от величины частичного
положительного заряда на атоме углерода, его пространственной доступности и кислотно-основных свойств среды.
С учетом электронных эффектов групп, связанных с карбонильным атомом углерода, величина частичного положительного заряда δ+ на нем в альдегидах и кетонах убывает в следующем ряду:

Пространственная доступность карбонильного атома углерода уменьшается при замене водорода более объемистыми органиче- скими радикалами, поэтому альдегиды более реакционноспособны, чем кетоны.

Общая схема реакций нуклеофильного присоединения A N к карбонильной группе включает нуклеофильную атаку по карбонильному атому углерода, за которой следует присоединение электрофила к атому кислорода.

В кислой среде активность карбонильной группы, как правило, увеличивается, поскольку вследствие протонирования атома кислорода на атоме углерода возникает положительный заряд. Кислотный катализ используют обычно тогда, когда атакующий нуклеофил обладает низкой активностью.
По приведенному выше механизму осуществляется ряд важных реакций альдегидов и кетонов.
Многие свойственные альдегидам и кетонам реакции протекают в условиях организма, эти реакции представлены в последующих разделах учебника. В настоящей главе будут рассмотрены наиболее важные реакции альдегидов и кетонов, которые в обзорном виде приведены на схеме.

Присоединение спиртов. Спирты при взаимодействии с альдегидами легко образуют полуацетали.Полуацетали обычно не выделяют из-за их неустойчивости. При избытке спирта в кислой среде полуацетали превращаются в ацетали.

Применение кислотного катализатора при превращении полуацеталя в ацеталь становится понятным из приведенного ниже механизма реакции. Центральное место в нем занимает образование карбо- катиона (I), стабилизированного за счет участия неподеленной пары электронов соседнего атома кислорода (+M-эффект группы С 2 Н 5 О).

Реакции образования полуацеталей и ацеталей обратимы, поэтому ацетали и полуацетали легко гидролизуются избытком воды в кислой среде. В щелочной среде полуацетали устойчивы, так как алкоксидион является более трудно уходящей группой, чем гидроксид-ион.
Образование ацеталей часто используется как временная защита альдегидной группы.
Присоединение воды. Присоединение воды к карбонильной группе – гидратация – обратимая реакция. Степень гидратации альдегида или кетона в водном растворе зависит от строения субстрата.
Продукт гидратации, как правило, в свободном виде выделить с помощью перегонки не удается, так как он разлагается на исходные компоненты. Формальдегид в водном растворе гидратирован более чем на 99,9%, ацетальдегид – приблизительно наполовину, ацетон практически не гидратирован.

Формальдегид (муравьиный альдегид) обладает способностью свертывать белки. Его 40% водный раствор, называемый формалином, применяется в медицине как дезинфицирующее средство и консервант анатомических препаратов.
Трихлороуксусный альдегид (хлораль) гидратирован полностью. Электроноакцепторная трихлорометильная группа настолько стабилизирует хлоральгидрат, что это кристаллическое вещество отщепляет воду только при перегонке в присутствии дегидратирующих веществ – серной кислоты и др.

В основе фармакологического эффекта хлоральгидрата СС1 3 СН(ОН) 2 лежит специфическое действие на организм альдегидной группы, обусловливающее дезинфицирующие свойства. Атомы галогена усиливают ее действие, а гидратация карбонильной группы снижает токсичность вещества в целом.
Присоединение аминов и их производных. Амины и другие азотсодержащие соединения общей формулы NH2X (X = R, NHR) реагируют с альдегидами и кетонами в две стадии. Сначала образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. В связи с этим данный процесс в целом классифицируют как реакцию присоединения-отщепления.

В случае первичных аминов получаются замещенные имины (их называют также основаниями Шиффа).
Имины – промежуточные продукты многих ферментативных процессов. Получение иминов проходит через стадию образования аминоспиртов, которые бывают относительно устойчивы, например при взаимодействии формальдегида с α-аминокислотами.
Имины являются промежуточными продуктами получения аминов из альдегидов и кетонов путём восстановительного аминирования. Этот общий способ заключается в восстановлении смеси карбонильного соединения с аммиаком (или амином). Процесс протекает по схеме присоединения-отщепления с образованием имина, который затем восстанавливается в амин.
При взаимодействии альдегидов и кетонов с производными гидразина получаются гидразоны. Эту реакцию можно использовать для выделения альдегидов и кетонов из смесей и их хроматографической идентификации.

Основания Шиффа и другие подобные соединения легко гидролизуются водными растворами минеральных кислот с образованием исходных продуктов.
В большинстве случаев для реакций альдегидов и кетонов с азотистыми основаниями необходим кислотный катализ, ускоряющий дегидратацию продукта присоединения. Однако если слишком повысить кислотность среды, то реакция замедлится в результате превращения азотистого основания в нереакционноспособную сопряженную кислоту XNH3+.
Наличие СН-кислотного центра в молекуле альдегида или кетона приводит к тому, что α-атомы водорода этих карбонильных соединений обладают некоторой протонной подвижностью. Под действием оснований такие протоны могут отщепляться с образованием соответствующих карбанионов. Карбанионы играют роль нуклеофилов по отношению к карбонильному субстрату. Это обусловливает возможность осуществления реакций, в которых одна молекула в качестве нуклеофила присоединяется к карбонильной группе другой молекулы нейтрального карбонильного соединения. Такие процессы относятся к реакциям конденсации.
Конденсацией называют реакцию, приводящую к возникновению новой углерод-углеродной связи, причем из двух или нескольких относительно простых молекул образуется новая, более сложная молекула.
Так, в щелочной среде из двух молекул ацетальдегида образуется гидроксиальдегид с удвоенным числом атомов углерода.
Продукт реакции, содержащий гидроксильную и альдегидную группы, называется альдолем (от слов альдегид и алкоголь), а сама реакция получила название альдольной конденсации, или альдольного присоединения.
При действии основания в карбонильном соединении отщепляется протон из α-положения и образуется карбанион (I), в котором отрицательный заряд делокализован при участии карбонильной группы.

Анион (I) представляет собой сильный нуклеофил (на следующей стадии механизма он показан цветом), который присоединяется ко второй (неионизированной) молекуле карбонильного соединения. В результате такого взаимодействия возникает новая связь С-С и образуется промежуточный алкоксид-ион (II). В водной среде этот анион стабилизируется, отщепляя протон от молекулы воды, и превращается в конечный продукт – альдоль.

Реакция альдольного присоединения показана на примере пропаналя (цветом выделена молекула, присоединяющаяся к группе С=О другой молекулы); аналогичная реакция приведена на примере ацетона.

Продукт конденсации – альдоль – способен к отщеплению воды с образованием α,β-ненасыщенного карбонильного соединения. Обычно это происходит при повышенной температуре. В этом случае реакция в целом называется кротоновой конденсацией.
Реакции конденсации могут протекать и в смешанном варианте, с использованием разных карбонильных соединений, причем одно из них может и не содержать СН-кислотного центра, как, например, формальдегид и бензальдегид в следующих реакциях:

Альдольная конденсация – обратимая реакция; обратный процесс называется альдольным расщеплением (или ретроальдольной реакцией). Обе реакции происходят во многих биохимических процессах.
2. Нуклеозиды. Гидролиз нуклеозидов. Нуклеотиды. Строение мононуклеотидов, образующих нуклеиновые кислоты. Гидролиз нуклеотидов. Рибонуклеиновые и дезоксирибонуклеиновые кислоты (РНК, ДНК). Роль фодородных связей в формировании вторичной структуры ДНК.
В химии нуклеиновых кислот входящие в их состав гетероциклические соединения пиримидинового и пуринового рядов обычно называют нуклеиновыми основаниями. Нуклеиновые основания в качестве заместителей в гетероцикле могут содержать: либо оксогруппу, как в урациле и тимине; либо аминогруппу, как в аденине; либо одновременно обе эти группы, как в цитозине и гуанине.

Нуклеиновые кислоты различаются входящими в них гетероциклическими основаниями: урацил входит только в РНК, а тимин – в ДНК:

Нуклеиновые основания образуют связь за счет одного из атомов азота с аномерным центром пентозы (D-рибозы или 2-дезокси-D- рибозы). Этот тип связи аналогичен обычной гликозидной связи и известен как N-гликозидная связь, а сами гликозиды – как N-гликозиды. В химии нуклеиновых кислот их называют нуклеозидами. В состав природных нуклеозидов пентозы входят в фуранозной форме (атомы углерода в них нумеруют цифрой со штрихом). Гликозидная связь осуществляется с атомом азота N-1 пиримидинового и N-9 пуринового оснований.

Природные нуклеозиды всегда являются β-аномерами. В зависимости от природы углеводного остатка различают рибонуклеозиды и дезоксирибонуклеозиды. Для нуклеозидов употребительны названия, производимые от тривиального названия соответствующего нуклеинового основания с суффиксами -идин у пиримидиновых и -озин у пуриновых нуклеозидов.

Исключение составляет название «тимидин» (а не дезокситимидин), используемое для дезоксирибозида тимина, входящего в состав ДНК. В тех редких случаях, когда тимин встречается в РНК, соответствующий нуклеозид называется риботимидином. Трехбуквенные символы нуклеозидов отличаются от символов оснований последней буквой. Однобуквенные символы применяются только для остатков (радикалов) нуклеозидов в более сложных структурах. Нуклеозиды устойчивы к гидролизу в слабощелочной среде, но гидролизуются в кислой. Пуриновые нуклеозиды гидролизуются легко, пиримидиновые труднее.


Нуклеотидами называют фосфаты нуклеозидов. Фосфорная кислота обычно этерифицирует спиртовый гидроксил при С-5" или С-3" в остатке рибозы (рибонуклеотиды) или дезоксирибозы (дезоксирибонуклеотиды). Общий принцип строения нуклеотидов показан на примере фосфатов аденозина. Для связывания трех компонентов в молекуле нуклеотида используются сложноэфирная и N-гликозидная связи. Нуклеотиды можно рассматривать, с одной стороны, как эфиры нуклеозидов (фосфаты), а с другой – как кислоты (в связи с наличием остатка фосфорной кислоты).

За счет фосфатного остатка нуклеотиды проявляют свойства двухосновной кислоты и в физиологических условиях при рН ~7 находятся в полностью ионизированном состоянии.

Для нуклеотидов используют два вида названий (табл. 14.1). Одно включает наименование нуклеозида с указанием положения в нем фосфатного остатка, например, аденозин-3"-фосфат, уридин-5"-фос- фат; другое строится с добавлением сочетания -иловая кислота к названию остатка пиримидинового основания, например, 5"-уридило- вая кислота, или пуринового основания, например 3"-адениловая кислота. Используя принятый для нуклеозидов однобуквенный код, 5"-фосфаты записывают с добавлением латинской буквы «р» перед символом нуклеозида, 3"-фосфаты – после символа нуклеозида. Аденозин-5"-фосфат обозначается рА, аденозин-3"-фосфат – Ар и т. п. Эти сокращенные обозначения используют для записи последовательности нуклеотидных остатков в нуклеиновых кислотах. По отношению к свободным нуклеотидам в биохимической литературе широко используют их названия как монофосфатов с отражением этого признака в сокращенном коде, например АМР (или АМФ) для аденозин-5"-фосфата и т. д. (см. табл. 14.1).

К циклофосфатам относятся нуклеотиды, у которых одна молекула фосфорной кислоты этерифицирует одновременно две гидроксильные группы углеводного остатка. Практически во всех клетках присутствуют два нуклеозидциклофосфата – аденозин-3",5"- циклофосфат (cAMP) и гуанозин-3",5"-циклофосфат (cGMP). В полинуклеотидных цепях нуклеотидные звенья связаны через фосфатную группу. Фосфатная группа образует две сложноэфирные связи: с С-3" предыдущего и с С-5" последующего нуклеотидных звеньев. Каркас цепи состоит из чередующихся пентозных и фосфатных остатков, а гетероциклические основания являются «боковыми» группами, присоединенными к пентозным остаткам. Нуклеотид со свободной 5"-ОН группой называют 5"-концевым, а нуклеотид со свободной З"-ОН группой – З"-концевым. Принцип построения цепи РНК такой же, как и у ДНК, с двумя исключениями: пентозным остатком в РНК служит D-рибоза, а в наборе гетероциклических оснований используется не тимин, а урацил. Первичная структура нуклеиновых кислот определяется последовательностью нуклеотидных звеньев, связанных ковалентными связями в непрерывную цепь полинуклеотида.


Важной характеристикой нуклеиновых кислот служит нуклеотидный состав, т.е. набор и количественное отношение нуклеотидных компонентов. Нуклеотидный состав устанавливают, как правило, путем исследования продуктов гидролитического расщепления нуклеиновых кислот. Водородные связи участвуют в формировании вторичной и третичной структуры белка, а также связывают друг с другом две спирали ДНК.

Нуклеозиды значительно лучше растворимы в воде, чем исходные азотистые основания. Подобно всем гликозидам, нуклеозиды устойчивы к действию щелочей, но при нагревании легко подвергаются кислотному гидролизу с разрывом гликозидной связи и образованием основания и пентозы:

НО – N = O → CH 2 –CH – COOH
5. Получите β-гидроксимасляную кислоту из этаналя. Укажите условия реакций. Какие вам известны биологически важные реакции, протекающие по типу альдольной конденсации?
CH 3 – COH + OH - → CН 2 - – COH + H 2 O
CH 3 – COH + CН 2 - – COH → CH 3 – CН – CH 2 – COH → (+H 2 O,-OH -)
(+H 2 O,-OH -) → CH 3 – CН – CH 2 – COH
CH 3 – CН – CH 2 – COH + 2OH → CH 3 – CН – CH 2 – COOH +
2Ag + 4NH 3 + H 2 O
Интересно, что в живых организмах альдольная реакция также используется достаточно часто. Например, она входит в последовательность стадий биосинтеза глюкозы - глюконеогенез, а также в обратный процесс гликолиза, который приводит к разложению глюкозы. Подобные процессы в организмах катализируются специальными ферментами - альдолазами.
Являются производными углеводородов, в молекулах которых два атома водорода, находившиеся при одном атоме углерода, замещены атомом кислорода. Получающаяся таким путем группа >С=О называется карбонильной группой, или оксогруппой. Если карбонильная группа связана с одним водородным атомом и углеводородным радикалом (или с двумя атомами водорода), то такие соединения называют альдегидами, а группу - альдегидной, если карбонильная группа связана с двумя углеводородными радикалами, соединения называют кетонами, а группу - кетогруппой. Таким образом, альдегиды и кетоны представляют собой один класс органических веществ - оксосоединения.
Атомные орбитали углерода карбонильной группы находятся в состоянии sp 2 -гибридизации. Три гибридные орбитали, расположенные в одной плоскости под углом » 120 ° друг по отношению к другу, участвуют в образовании трех s- связей. Негибридная р-орбиталь атома углерода, расположенная перпендикулярно плоскости, в которой лежат s- связи, участвует в образовании p-связи с атомом кислорода. Двойная связь углерод-кислород полярная, электронная плотность смещена к более электроотрицательному атому кислорода, на котором возникает частичный отрицательный заряд, а на атоме углерода карбонильной группы - частичный положительный заряд:
Из этого следует, что характерной для карбонильной группы реакцией должна быть нуклеофильная атака по атому углерода. В молекулах карбонильных соединений, кроме электрофильного центра - атома углерода оксогруппы - есть и другие реакционные центры. Атом кислорода за счет неподеленной пары электронов выступает в реакциях как основный центр, реагируя с кислотами. Альдегиды и кетоны являются слабыми основаниями, концентрация протонированной формы карбонильного соединения достигает величин » 0,1-1% только в 60-80% серной кислоте.
В результате присоединения протона за счет образования s -связи О-Н возрастает электрофильность атома углерода оксогруппы и облегчается присоединение нуклеофильной частицы.
Гидратация кетонов возможна лишь в присутствии кислот или щелочей как катализаторов.
Механизм реакции гидратации при кислотном катализе:
На первом этапе протон присоединяется к атому кислорода карбонильной группы (за счет неподеленной пары электронов кислорода) с образованием оксониевого катиона, который на следующем этапе превращается в карбкатион, легко (за счет целого положительного заряда на углероде) подвергающийся нуклеофильной атаке молекулой воды. Образующийся оксониевый катион стабилизируется отщеплением протона (возврат катализатора).
Механизм реакции гидратации при основном катализе:
При проведении гидратации в щелочной среде гидроксид-ион атакует электрофильный атом углерода карбонильной группы с образованием оксониевого аниона, который далее стабилизируется путем отщепления протона от молекулы воды.
В отличие от большинства карбонильных соединений, 2,2,2-трихлорэтаналь (хлораль) легко реагирует с водой, образуя устойчивый продукт гидратации - хлоральгидрат, используемый в медицине и ветеринарии как успокаивающее и снотворное средство. Повышенная реакционная способность этого соединения объясняется сильным электроноакцепторным эффектом трихлорметильной группы, которая увеличивает эффективный положительный заряд на атоме углерода карбонильной группы, а также стабилизирует продукт реакции.
Реакции присоединения спиртов
В присутствии сухого хлороводорода альдегиды реагируют со спиртами, образуя ацетали. Промежуточно образующиеся полуацетали в большинстве случае в свободном виде выделить не представляется возможным. Необходимо отметить, что превращение полуацеталей в ацетали без кислотных катализаторов не происходит.
Превращение альдегидов в полуацетали происходит по механизму нуклеофильного присоединения А N , а последующее превращение полуацеталя в ацеталь представляет нуклеофильное замещение.
Необходимость использования кислотного катализа при превращении полуацеталей в ацетали обусловлена тем, что ОН-группа является плохо уходящей. Для превращения ее в хорошо уходящую группу - молекулу Н 2 О - используют кислоты в качестве катализаторов.
В случае реакций кетонов со спиртами положительный заряд на атоме углерода карбонильной группы оказывается недостаточным для непосредственной атаки молекулой спирта, и кетали одноатомных спиртов таким путем получить нельзя. Их получают с использованием ортоэфиров муравьиной кислоты.
Реакции образования полуацеталей и ацеталей характерны для природных гетерополифункциональных соединений - углеводов. Моносахариды являются, как правило, полигидроксиальдегидами или полигидроксикетонами, внутри молекул которых между гидроксильной и карбонильной группами происходит взаимодействие, приводящее к образованию гетероцикла:
Циклические формы моносахаридов являются циклическими полуацеталями или циклическими полукеталями. Образование олигосахарид ов и полисахаридов представляет собой реакцию образования ацеталя, повторяющуюся многократно:
Полисахариды, как ацетали, подвергаются гидролизу только в кислой среде.
Присоединение меркаптанов RSH к альдегидам и кетонам приводит к образованию, соответственно, тиоацеталей. Способность молекул меркаптанов эффективно атаковать атом углерода карбонильной группы кетонов отражает большую склонность RSH (по сравнению с ROH) к образованию эффективных нуклеофилов RS - , т.е большую кислотность тиолов по сравнению со спиртами.