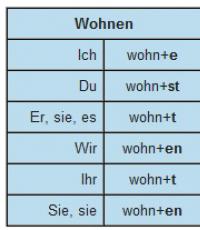
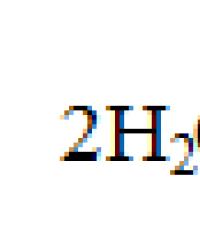Диаграмма состояния воды и правило фаз. Фазовая диаграмма воды Кривая сублимации льда
Сначала договоримся, что под термином "вода" будем понимать Н 2 О в любом из возможных ее фазовых состояний.
В природе вода может быть в трех состояниях: твердой фазе (лед, снег), жидкой фазе (вода), газообразной фазе (пар).
Рассмотрим воду без энергетического взаимодействия с окружающей средой, т.е. в равновесном состоянии.
У поверхности льда или жидкости всегда находится пар. Соприкасающиеся фазы находятся в термодинамическом равновесии: быстрые молекулы вылетают из жидкой фазы, преодолевая поверхностные силы, а из паровой фазы медленные молекулы переходят в жидкую фазу.
В состоянии равновесия каждой температуре соответствует определенное давление пара - полное (если над жидкостью только пар) или парциальное (если присутствует смесь пара с воздухом или другими газами). Пар, находящийся в равновесном состоянии с жидкой фазой, из которой он образовался, называется насыщенным паром, а соответствующая ему температура называется температурой насыщения, а давление - давлением насыщения.
Неравновесное состояние воды:
а) Механически неравновесное состояние. Пусть понижается давление пара над жидкостью ниже давления насыщения. В этом случае нарушается равновесие, происходит некомпенсированный переход вещества из жидкой фазы в газообразную через поверхность раздела фаз за счет наиболее быстрых молекул.
Процесс некомпенсированного перехода вещества из жидкой фазы в газообразную называется испарением.
Процесс некомпенсированного перехода вещества из твердой фазы в газовую называется сублимацией или возгонкой.
Интенсивность испарения или сублимации возрастает при интенсивном отводе образующегося пара. При этом понижается температура жидкой фазы за счет вылета из нее молекул с наибольшей энергией. Этого можно добиться и без понижения давления, просто обдувом поверхности жидкости потоком воздуха.
б) Тепловая неравновесность. Пусть идет подвод теплоты к жидкости, находящейся в открытом сосуде. При этом температура, а соответственно и давление насыщенного пара над жидкостью растет и может достигнуть полного внешнего давления (Р=Р Н). В случае, когда Р=Р Н, у поверхности нагрева температура жидкости поднимается выше температуры насыщенного пара при господствующем здесь давлении, т.е. создаются условия образования пара в толще жидкости.
Процесс перехода вещества из жидкой фазы в паровую непосредственно внутри жидкости называется кипением.
Процесс зарождения пузырьков пара в толще жидкости сложен. Для кипения воды необходимо наличие центров парообразования на поверхности подвода теплоты - углубления, выступы, неровности и т.п. У поверхности нагрева, при кипении, разность температур воды и насыщенного пара при господствующем здесь давлении зависит от интенсивности подвода теплоты и может достигать десятков градусов.
Действие сил поверхностного натяжения жидкости обусловливает перегрев жидкости на поверхности раздела фаз при ее кипении на 0,3-1,5 градуса по отношению к температуре насыщенного пара над ней.
Любой процесс перехода вещества из жидкой фазы в паровую называется парообразованием.
Процесс, противоположный парообразованию, т.е. некомпенсированный переход вещества из паровой фазы в жидкую, называется конденсацией.
При постоянном давлении пара конденсация происходит (как и кипение) при постоянной температуре и является результатом отвода теплоты от системы.
Процесс, противоположный сублимации, т.е. переход вещества из паровой фазы непосредственно в твердую, называется десублимацией.
Напомним, что введенные ранее понятия насыщенного пара и температуры насыщения, перенесенные на процесс кипения, приводят к равенству температур пара и жидкости. В этом случае и давление и температура жидкой и паровых фаз одинаковы.
Жидкая фаза воды при температуре кипения называется насыщенной жидкостью.
Пар при температуре кипения (насыщения) называется сухим насыщенным паром.
Двухфазная смесь "жидкость+пар" в состоянии насыщения называется влажным насыщенным паром.
В термодинамике этот термин распространяется на двухфазные системы, в которых насыщенный пар может находиться над уровнем жидкости или представлять смесь пара с взвешенными в нем капельками жидкости. Для характеристики влажного насыщенного пара используется понятие степени сухости х,представляющее собой отношение массы сухого насыщенного пара , m С.Н.П. , к общей массе смеси , m СМ = m С.Н.П. + m Ж.С.Н. , его с жидкостью в состоянии насыщения:
Подвод теплоты к влажному насыщенному пару при постоянном давлении приводит к переходу жидкой фазы смеси в паровую. При этом температура смеси (насыщения) не может быть повышена до тех пор, пока вся жидкость не будет превращена в пар. Дальнейший подвод теплоты только к паровой фазе в состоянии насыщения приводит к повышению его температуры.
Пар с температурой выше температуры насыщения при данном давлении называется перегретым паром. Разность температур перегретого пара t и насыщенного пара того же давления t Н называется степенью перегрева пара D t П = t -t Н.
С увеличением степени перегрева пара его объем растет, концентрация молекул уменьшается, по своим свойствам он приближается к газам.
В физической химии системой называется тело или группа тел, выделенных из материального мира и имеющих определенные границы, которые отделяют их от окружающей среды. Системы могут быть гомогенными и гетерогенными . Система является гомогенной, если каждый параметр имеет во всех ее частях одинаковое значение или непрерывно изменяется от точки к точке. Например, вода дистиллированная (в каком7либо сосуде) - система гомогенная, так как в любой точке все свойства этой воды или одинаковы (плотность, удельная электропроводимость, теплопроводность и др.), или непрерывно изменяются от центра системы к ее границам (например, температура). К гомогенным системам относятся смеси газов, молекулярные и ионные растворы.
Гетерогенная система состоит из нескольких макроскопических частей, отделенных одна от другой видимыми поверхностями раздела. На этих поверхностях некоторые параметры изменяются скачком. Если создать насыщенный раствор какой-либо соли в воде, чему сопутствует наличие твердой соли на дне сосуда, то такая система "раствор + твердая соль" гетерогенна. В этом примере на границе раздела скачкообразно изменяются химический состав и плотность. Гомогенные части системы, отделенные от остальных частей видимыми поверхностями раздела, называются фазами . Например, совокупность кристаллов соли в насыщенном растворе составляет одну фазу, раствор над твердой солью - другую.
Состояние системы описывается совокупностью ее свойств (или свойств фаз) - температурой, давление, массой, плотностью, химическим составом, а также связями между изменениями этих свойств.
Каждое вещество, которое может быть выделено из системы и существовать вне ее, называется составляющим веществом. В водном растворе хлористого натрия составляющими веществами могут быть Н 2 O и NaCl, но не ионы Na + и Cl - , так как они не могут существовать вне раствора.
Важная характеристика системы - число компонентов (k), под которым понимают наименьшее число составляющих веществ, с помощью которых можно описать состав каждой фазы системы в отдельности.
Если в системе не протекает химических реакций, число компонентов равно числу составляющих веществ. Например, в однофазной системе из газообразных гелия, водорода и аргона число компонентов равно числу составляющих веществ, т.е. трем, так как реакции между этими газами невозможны.
В системе, где составляющие вещества способны взаимодействовать друг с другом, число компонентов всегда меньше числа составляющих веществ. Например, водород и газообразный иод реагирует с образованием газообразного иодистого водорода. В этой системе
H 2 (г) + I 2 (г) = 2HL(г)
концентрации составляющих веществ при равновесии связаны уравнением
2 / = K,
где К - константа равновесия, имеющая определенное значение при заданной температуре. В этом случае для определения состава равновесной системы достаточно знать концентрации любых двух составляющих веществ, так как концентрация третьего определяется уравнением. Иными словами, система имеет два компонента. В общем случае число компонентов равно числу составляющих веществ минус число уравнений, связывающих концентрации этих веществ в равновесной системе.
Для описания системы необходим еще один параметр - число степеней свободы с , которое означает число независимых переменных (температура, давление, концентрация составляющих веществ), определяющих термодинамическое состояние равновесия системы. Значения этих переменных можно в известных пределах произвольно изменять, не меняя числа и вида фаз в системе. По числу степеней свободы системы называют инвариантными, у которых число степеней свободы равно нулю, моновариантными - с одной степенью свободы, бивариантными - с двумя и т.д.
В 1876 г. Гиббсом было сформулировано правило фаз, которое охватывает все случаи равновесия систем как гомогенных, так и гетерогенных. Это правило гласит: Число степеней свободы с равновесной термодинамической системы, на которую из внешних факторов влияют только давление и температура, равно числу компонентов системы k плюс 2 и минус число фаз f , т.е.
c = k + 2 - f
Диаграмма состояния - наглядный способ представления областей существования различных фаз в зависимости от внешних условий, например от давления и температуры.
Диаграмма состояния воды - система с одним компонентом H 2 O, поэтому наибольшее число фаз, которые одновременно могут находиться в равновесии, равно трем. Эти три фазы - жидкость, лед, пар. Число степеней свободы в этом случае равно нулю, т.е. нельзя изменить ни давление, ни температуру, чтобы не исчезла ни одна из фаз. Обычный лед, жидкая вода и водяной пар могут существовать в равновесии одновременно только при давлении 0,61 кПа и температуре 0,0075°С. Точка сосуществования трех фаз называется тройной точкой (O ).
Кривая ОС разделяет области пара и жидкости и представляет собой зависимость давления насыщенного водяного пара от температуры. Кривая ОС показывает те взаимосвязанные значения температуры и давления, при которых жидкая вода и водяной пар находятся в равновесии друг с другом, поэтому она называется кривой равновесия жидкость-пар или кривой кипения.
Кривая ОВ отделяет область жидкости от области льда. Она является кривой равновесия твердое состояние-жидкость и называется кривой плавления. Эта кривая показывает те взаимосвязанные пары значений температуры и давления, при которых лед и жидкая вода находятся в равновесии.
Кривая OA называется кривой сублимации и показывает взаимосвязанные пары значений давления и температуры, при которых в равновесии находятся лед и водяной пар.
При k н = 1 уравнение правила фаз примет вид:
С = 3 - Ф,
Если в равновесии 1 фаза, то С = 2 , говорят, что система бивариантна ;
2 фазы С = 1, система моновариантна ;
3 фазы С = 0, система инвариантна .
Диаграмма, выражающая зависимость состояния системы от внешних условий или от состава системы, называется фазовой диаграммой . Соотношение между давлением (р ), температурой (Т ) и объемом (V ) фазы можно представить трехмерной фазовой диаграммой. Каждая точка (ее называют фигуративной точкой ) на такой диаграмме изображает некоторое равновесное состояние. Обычно удобнее работать с сечениями этой диаграммы плоскостью р - Т (при V = const ) или плоскостью р -V (при T = const ). Разберем более детально случай сечения плоскостью р - Т (при V=const ).
Рассмотрим в качестве примера фазовую диаграмму однокомпонентной системы – воды (Рис.8).
Фазовая диаграмма воды
Фазовая диаграмма воды в координатах р - Т представлена на Рис.8. Она составлена из 3 фазовых полей - областей различных (р, Т )-значений, при которых вода существует в виде определенной фазы - льда, жидкой воды или пара (обозначены на Рис.8 буквами Л, Ж и П, соответственно). Для этих однофазных областей число степеней свободы равно двум, равновесие бивариантно (С = 3 - 1 = 2 ). Это означает, что для описания системы необходимы две независимые переменные - температура и давление. Эти переменные могут изменяться в данных областях независимо, и при этом не произойдет изменения вида и числа фаз.
Фазовые поля разделены 3-мя граничными кривыми.
Кривая АВ - кривая испарения , выражает зависимость давления пара жидкой воды от температуры (или, наоборот, представляет зависимость температуры кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию жидкая вода-пар, и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 - 2 = 1 . Такое равновесие моновариантно. Это означает, что для полного описания системы достаточно определить только одну переменную - либо температуру, либо давление. Вторая переменная является зависимой, она задается формой кривой АВ. Таким образом, для данной температуры существует только одно равновесное давление или для данного давления пара- только одна равновесная температура.
При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара.
При давлениях и температурах, соответствующих точкам выше линии АВ, пар полностью сконденсирован в жидкость (С = 2 ). Верхний предел кривой испарения AB находится в точке В, которая называется критической точкой (для воды 374 o С и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/пар), поэтому Ф=1.
Линия АС - эта кривая возгонки льда (иногда ее называют линией сублимации), отражающая зависимость давления водяного пара надо льдом от температуры . Эта линия соответствует моновариантному равновесию лед-пар (С=1 ). Выше линии АС лежит область льда, ниже - область пара.
Линия АD -кривая плавления , выражает зависимость температуры плавления льда от давления и соответствует моновариантному равновесию лед-жидкая вода. Для большинства веществ линия АD отклоняется от вертикали вправо, но поведение воды аномально: жидкая вода занимает меньший объем, чем лед . На основании принципа Ле Шателье можно предсказать, что повышение давления будет вызывать сдвиг равновесия в сторону образования жидкости, т.е. точка замерзания будет понижаться.
Рис.8. Фазовая диаграмма воды
Исследования, проведенные Бриджменом для определения хода кривой плавления льда при высоких давлениях, показали, что существует семь различных кристаллических модификаций льда , каждая из которых, за исключением первой, плотнее воды . Таким образом, верхний предел линии AD - точка D, где в равновесии находятся лед I (обычный лед), лед III и жидкая вода. Эта точка находится при -22 0 С и 2450 атм.
Тройная точка воды (точка, отражающая равновесие трех фаз - жидкости, льда и пара) в отсутствии воздуха находится при 0,0100 o С и 4,58 мм рт.ст. Число степеней свободы С =3-3=0 и такое равновесие называют инвариантным . При изменении любого параметра система перестает быть трехфазной.
В присутствии воздуха три фазы находятся в равновесии при 760 мм рт.ст. и при 0 o С. Понижение температуры тройной точки на воздухе вызвано следующим причинами:
1. растворимостью газообразных компонентов воздуха в жидкой воде при 1 атм, что приводит к снижению тройной точки на 0,0024 o С;
2. увеличением давления от 4,58 мм рт.ст. до 1 атм, которое снижает тройную точку еще на 0.0075 o С.
Энциклопедичный YouTube
1 / 5
✪ Фазовые диаграммы
✪ Основы молекулярной | физики фазовая диаграмма воды | 1
✪ Фазовая плоскость
✪ Критическое состояние эфира.
✪ Закон Генри
Субтитры
Все рассмотренные фазовые переходы были изобарическими, в частности фазовые переходы воды в последних роликах происходили при давлении на уровне моря, равном одной атмосфере. В реальности всё по-другому. В реальном мире нигде не поддерживается постоянное давление в 1 атмосферу. 1 атмосфера – это давление на уровне моря на Земле. Давление зависит от размера планеты, от толщины атмосферы, от условий, в которых существуют газы, жидкости и твердые тела. Итак, перед вами фазовая диаграмма. Я запишу. «Фазовая диаграмма». Есть несколько форм записи диаграммы. Это – самая популярная из них, на которой показаны агрегатные состояния и переходы между ними при изменении температуры и давления. Это диаграмма для воды. По оси ординат отложена величина давления, Давайте-ка подпишу. По оси абсцисс – температура, а области диаграммы соответствуют различным агрегатным состояниям: твердое тело, жидкость... жидкость и, наконец, газ. Посмотрим, какому агрегатному состоянию соответствует температура в 0 градусов. Так вот, температура 0 градусов Цельсия и давление в 1 атмосферу. На графике им соответствует вот эта точка. Это граница между твердым телом и жидкостью при давлении в 1 атмосферу. Давление здесь равно 1 атмосфере. Это соответствует общеизвестному факту, что лед плавится при 0 градусов. Что случится, если мы увеличим давление? Лед станет плавиться при меньшей температуре. Увеличим давление, например, до 10 атмосфер, что в 10 раз больше, чем давление на уровне моря. Температура, при которой твердое тело переходит в жидкое состояние, уменьшится. Если давление уменьшить, например оказаться в Денвере, который на милю выше уровня моря, то температура замерзания увеличится где-то до 1 градуса. Здесь не совсем верный масштаб, но суть в том, что лед замерзнет быстрее, то есть при более высокой температуре, в Денвере, чем на дне Мертвого моря или в Долине смерти, которые расположены ниже уровня моря. Область справа от фиолетовой линии соответствует газу. Вернемся к атмосферному давлению. Это диаграмма для воды. Мы знаем, как она себя ведет при давлении в 1 атмосферу. Я проведу линию. При давлении в 1 атмосферу и температуре 0 градусов твердый лед превращается в жидкую воду. Двигаясь вдоль этой линии, мы попадаем в область высокой температуры. В этой точке графика температура равна 100 градусам. При такой температуре и давлении в 1 атмосферу жидкая вода превращается в водяной пар, то есть вскипает. Это температура кипения воды. Что, если снизить давление? Вновь отправимся в Денвер. Вот Денвер. Хотя нет, нужно что-то более наглядное. Пусть лучше это будет гора Эверест, там давление низкое. C понижением давления температура замерзания растет, а кипения – снижается, так что воду проще вскипятить на вершине Эвереста, чем у ее подножья или в низине Долины смерти. Представьте себе жидкость. В ней миллионы молекул, которые располагаются очень близко, но при этом обладают достаточной кинетической энергией, чтобы двигаться по отношению друг к другу. Молекулы движутся – жидкость течет. Молекулы не испаряются, не выпрыгивают наружу, потому что на них сверху давит воздух. О давлении воздуха я уже рассказывал. Давление, создаваемое молекулами газа, зависит от их температуры, а также от кинетической энергии. Молекулы газа находятся сверху и не позволяют молекулам жидкости выпрыгивать. Они не дают им отделиться друг от друга и превратиться в газ. Чем больше давление, тем сложнее молекулам сбежать. А теперь перенесем жидкость в вакуум, на поверхность Луны, где нет воздуха, и слегка встряхнем. Эти молекулы по-прежнему притягиваются друг к другу, но в отсутствие внешнего давления небольшого толчка хватит им, чтобы превратиться в газ. Чем ниже давление, тем легче жидкости, даже твердому телу стать газом. Даже твердые тела испаряются. Для этого нужно очень низкое давление. Посмотрите на левую часть графика. Это практически вакуум. Возьмите лед на поверхность Луны, в область с нужной температурой, я уверен, что там минус, но не помню, сколько именно, лед испарится, превращаясь в пар. В условиях глубокого вакуума молекулам вещества достаточно малейшего толчка, чтобы начать испаряться. И такое может произойти не только на Луне. Чтобы было понятнее, рассмотрим фазовую диаграмму двуокиси углерода. Вот она, смотрите. Это углекислый газ. Мы его выдыхаем, зеленые растения его потребляют. И это вещество при 1 атмосфере ведет себя иначе, чем вода. Обратите внимание, масштаб здесь не соблюден. Расстояния между 1 и 5 атмосферамии между пятью и семидесятью тремя на самом деле не равны между собой. Здесь тоже не выдержан масштаб. Если бы это было важно, я бы, наверное, использовал логарифмический масштаб. Но вернемся к двуокиси углерода. Вот твердая двуокись углерода, вот газ, а вот жидкое вещество. При давлении в одну атмосферу, то есть на уровне моря, например, как в Новом-Орлеане, если создать температуру -80 градусов Цельсия, двуокись углерода замерзнет. Вы с этим сталкивались. Не уверен, что его до сих пор используют в дымогенераторах, но ведь все слышали про сухой лед. Это твердая двуокись углерода. При атмосферном давлении на уровне моря при температуре -78,5 градусов он сублимируется. Сублимация – это переход из твердого состояния в жидкое. Запишу это. Поэтому не существует такого вещества, как жидкая двуокись углерода. Я такого никогда не видел. Чтобы сделать двуокись углерода жидкой, нужно давление в 5 атмосфер, то есть в 5 раз выше, чем давление на уровне моря. Такое возможно на Юпитере или Сатурне, где давление огромное из-за гравитации и толщины атмосферы. Жидкая двуокись углерода встречается в естественных условиях на газовых планетах-гигантах. А на Земле сухой лед возгоняется. Это синоним для сублимации. Из твердого состояния в газообразное, минуя жидкость. Есть еще кое-то интересное, и вы уже могли это заметить. Эта точка называется тройной, потому что при пяти атмосферах и минус 56 градусах Цельсия двуокись углерода находится в состоянии равновесия между льдом, жидкостью и газом. Понемногу в каждом из них. Можно подтолкнуть вещество в сторону одного из состояний, изменив условия. А вот тройная точка для воды. При давлении ниже, чем атмосферное. Это 611 паскаль, что где-то в 200 раз меньше, чем одна атмосфера. При таком давлении и температуре чуть выше 0 расположена тройная точка воды. Здесь вода находится в равновесии между этими тремя состояниями. Есть еще одна интересная точка – здесь. Критическая точка. Звучит серьезно и важно, не так ли? Если поднять температуру или давление еще выше, получится сверхкритическая жидкость. Звучит круто. Все, что дальше, – сверхкритическая жидкость. С высокой температурой и давлением. Температура делает из нее газ, но давление превращает в жидкость – это и то, и другое. Сверхкритическая вода используется как растворитель. Она ведет себя как жидкая вода, в ней можно растворять вещества, а еще она может проникать в твердые тела и просачиваться куда угодно, чтобы убрать какое-то загрязнение или растворить какую-либо соль. Сверхкритические жидкости очень интересны. И причина, по которой я показал вам эти диаграммы, в том, что давление так же может меняться, как и температура вещества. При температуре 100 градусов Цельсия или даже 110 на уровне моря вода будет газом. Вот отметка 110 градусов, и это водяной пар. Теперь увеличим значение давления, например углубимся под землю или на дно океана, и водяной пар сконденсируется в жидкость. Если переместиться в область более низких температур, можно увидеть явление, обратное сублимации. Вроде бы, я записывал его название. А, нет. Его нет. Оно подобно конденсации, но я забыл его название. Это переход из газообразного состояния напрямую в твердое, минуя жидкость. Польза этих диаграмм в том, что они позволяют предугадать поведение вещества при изменении давления и температуры. Subtitles by the Amara.org community
Элементы фазовой диаграммы
Тройные точки
| № | Фазы | Давление | Температура | Примечание | |||
|---|---|---|---|---|---|---|---|
| МПа | °C | K | |||||
| 1 | Пар | Вода | Лёд Ih | 611,657 Па | 0,01 | 273,16 | |
| 2 | Пар | Лёд Ih | Лёд XI | 0 | −201,0 | 72,15 | |
| 3 | Вода | Лёд Ih | Лёд III | 209,9 | −21,985 | 251,165 | |
| 4 | Лёд Ih | Лёд II | Лёд III | 212,9 | −34,7 | 238,45 | |
| 5 | Лёд II | Лёд III | Лёд V | 344,3 | −24,3 | 248,85 | |
| 6 | Лёд II | Лёд VI | Лёд XV | ~ 800 | −143 | 130 | Для D 2 O |
| 7 | Вода | Лёд III | Лёд V | 350,1 | −16,986 | 256,164 | |
| 8 | Вода | Лёд IV | Лёд XII | ~ 500-600 | ~ −6 | ~ 267 | |
| 9 | Лёд II | Лёд V | Лёд VI | ~ 620 | ~ −55 | ~ 218 | |
| 10 | Вода | Лёд V | Лёд VI | 632,4 | 0.16 | 273,32 | |
| 11 | Лёд VI | Лёд VIII | Лёд XV | ~ 1500 | −143 | 130 | Для D 2 O |
| 12 | Лёд VI | Лёд VII | Лёд VIII | 2100 | ~ 5 | ~ 278 | |
| 13 | Вода | Лёд VI | Лёд VII | 2216 | 81,85 | 355 | |
| 14 | Лёд VII | Лёд VIII | Лёд X | 62 000 | −173 | 100 | |
| 15 | Вода | Лёд VII | Лёд X | 47 000 | ~ 727 | ~ 1000 | |
Кривая сублимации льда
P = A ⋅ e x p (− B / T) , {\displaystyle P=A\cdot exp(-B/T),} A = 3 , 41 ⋅ 10 12 P a ; B = 6130 K . {\displaystyle A=3,41\cdot 10^{12}~\mathrm {Pa} ;\quad B=6130~\mathrm {K} .}
Ошибка этой формулы - не более 1 % в диапазоне температур 240-273,16 K и не более 2,5 % диапазоне температур 140-240 K.
Более точно кривая сублимации описывается формулой, рекомендованной IAPWS (англ.) русск. (англ. International Association for the Properties of Water and Steam - Международная ассоциация по изучению свойств воды и пара ) :
ln P P 0 = T 0 T ∑ i = 1 3 a i (T T 0) b i , {\displaystyle \ln {\frac {P}{P_{0}}}={\frac {T_{0}}{T}}\sum _{i=1}^{3}a_{i}\left({T \over T_{0}}\right)^{b_{i}},} P 0 = 611 , 657 P a ; T 0 = 273 , 16 K ; a 1 = − 21 , 2144006 ; b 1 = 0 , 003333333 ; a 2 = 27 , 3203819 ; b 2 = 1 , 20666667 ; a 3 = − 6 , 1059813 ; b 3 = 1 , 70333333. {\displaystyle {\begin{matrix}~P_{0}=611,657~\mathrm {Pa} ;&T_{0}=273,16~\mathrm {K} ;\\a_{1}=-21,2144006;&b_{1}=0,003333333;\\a_{2}=27,3203819;&b_{2}=1,20666667;\\a_{3}=-6,1059813;&b_{3}=1,70333333.\end{matrix}}}Кривая плавления льда Ih
P P 0 = 1 + ∑ i = 1 3 a i [ 1 − (T T 0) b i ] , {\displaystyle {\frac {P}{P_{0}}}=1+\sum _{i=1}^{3}a_{i}\left,} P 0 = 611 , 657 P a ; T 0 = 273 , 16 K ; a 1 = 1 195 393 , 37 ; b 1 = 3 , 00 ; a 2 = 80 818 , 3159 ; b 2 = 25 , 75 ; a 3 = 3 338 , 2686 ; b 3 = 103 , 75 ; {\displaystyle {\begin{matrix}~P_{0}=611,657~\mathrm {Pa} ;&T_{0}=273,16~\mathrm {K} ;\\a_{1}=1~195~393,37;&b1=3,00;\\a_{2}=80~818,3159;&b2=25,75;\\a_{3}=3~338,2686;&b3=103,75;\end{matrix}}}Кривая плавления льда III
Кривая плавления льда III начинается в точке минимальной температуры затвердевания воды (251,165 K; 208,566 МПа), где обычный лёд превращается в структурную модификацию III, и заканчивается в точке (256,164 K; 350,1 МПа), где проходит граница фаз III и V.
P P 0 = 1 − 0 , 299948 [ 1 − (T T 0) 60 ] , {\displaystyle {\frac {P}{P_{0}}}=1-0,299948\left,} P 0 = 208 , 566 M P a ; T 0 = 251 , 165 K . {\displaystyle P_{0}=208,566~\mathrm {MPa} ;\quad T_{0}=251,165~\mathrm {K} .}Кривая плавления льда V
Кривая плавления льда V начинается в точке (256,164 K; 350,1 МПа), на границе фаз III и V, и заканчивается в точке (273,31 K; 632,4 МПа), где проходит граница фаз V и VI.
P P 0 = 1 − 1 , 18721 [ 1 − (T T 0) 8 ] , {\displaystyle {\frac {P}{P_{0}}}=1-1,18721\left,} P 0 = 350 , 1 M P a ; T 0 = 256 , 164 K . {\displaystyle P_{0}=350,1~\mathrm {MPa} ;\quad T_{0}=256,164~\mathrm {K} .}Кривая плавления льда VI
Кривая плавления льда VI начинается в точке (273,31 K; 632,4 МПа), на границе фаз V и VI, и заканчивается в точке (355 K; 2216 МПа), где проходит граница фаз VI и VII.
P P 0 = 1 − 1 , 07476 [ 1 − (T T 0) 4 , 6 ] , {\displaystyle {\frac {P}{P_{0}}}=1-1,07476\left,} P 0 = 632 , 4 M P a ; T 0 = 273 , 31 K . {\displaystyle P_{0}=632,4~\mathrm {MPa} ;\quad T_{0}=273,31~\mathrm {K} .}Кривая плавления льда VII
Кривая плавления льда VII начинается в точке (355 K; 2216 МПа), на границе фаз VI и VII, и заканчивается в точке (715 K; 20,6 ГПа), где проходит граница фазы VII.
ln P P 0 = ∑ i = 1 3 a i (1 − (T T 0) b i) , {\displaystyle \ln {\frac {P}{P_{0}}}=\sum _{i=1}^{3}a_{i}\left(1-\left({T \over T_{0}}\right)^{b_{i}}\right),} P 0 = 2216 M P a ; T 0 = 355 K ; a 1 = 1 , 73683 ; b 1 = − 1 ; a 2 = − 0 , 0544606 ; b 2 = 5 ; a 3 = 8 , 06106 ⋅ 10 − 8 ; b 3 = 22. {\displaystyle {\begin{matrix}~P_{0}=2216~\mathrm {MPa} ;&T_{0}=355~\mathrm {K} ;\\a_{1}=1,73683;&b_{1}=-1;\\a_{2}=-0,0544606;&b_{2}=5;\\a_{3}=8,06106\cdot 10^{-8};&b_{3}=22.\end{matrix}}}Кривая насыщения водяного пара
Кривая насыщения водяного пара начинается в тройной точке воды (273,16 K; 611,657 Па) и заканчивается в критической точке (647,096 К; 22,064 МПа). Она показывает температуру кипения воды при указанном давлении или, что то же самое, давление насыщенного водяного пара при указанной температуре. В критической точке плотность водяного пара достигает плотности воды и, таким образом, различие между этими агрегатными состояниями исчезает.
β 2 θ 2 + n 1 β 2 θ + n 2 β 2 + n 3 β θ 2 + n 4 β θ + n 5 β + n 6 θ 2 + n 7 θ + n 8 = 0 , {\displaystyle \beta ^{2}\theta ^{2}+n_{1}\beta ^{2}\theta +n_{2}\beta ^{2}+n_{3}\beta \theta ^{2}+n_{4}\beta \theta +n_{5}\beta +n_{6}\theta ^{2}+n_{7}\theta +n_{8}=0,} θ = T T 0 + n 9 T T 0 − n 10 ; T 0 = 1 K ; {\displaystyle \theta ={T \over T_{0}}+{\frac {n_{9}}{{T \over T_{0}}-n_{10}}};\quad T_{0}=1~\mathrm {K} ;} β = (P P 0) 0 , 25 ; P 0 = 1 M P a ; {\displaystyle \beta =\left({\frac {P}{P_{0}}}\right)^{0,25};\quad P_{0}=1~\mathrm {MPa} ;} n 0 = 1 , 0 ; {\displaystyle n_{0}=1,0;} n 1 = 1167 , 0521452767 ; {\displaystyle n_{1}=1167,0521452767;} n 2 = − 724213 , 16703206 ; {\displaystyle n_{2}=-724213,16703206;} n 3 = − 17 , 073846940092 ; {\displaystyle n_{3}=-17,073846940092;} n 4 = 12020 , 82470247 ; {\displaystyle n_{4}=12020,82470247;} n 5 = − 3232555 , 0322333 ; {\displaystyle n_{5}=-3232555,0322333;} n 6 = 14 , 91510861353 ; {\displaystyle n_{6}=14,91510861353;} n 7 = − 4823 , 2657361591 ; {\displaystyle n_{7}=-4823,2657361591;} n 8 = 405113 , 40542057 ; {\displaystyle n_{8}=405113,40542057;} n 9 = − 0 , 23855557567849 ; {\displaystyle n_{9}=-0,23855557567849;} n 10 = 650 , 17534844798. {\displaystyle n_{10}=650,17534844798.}Для заданного абсолютного значения температуры T вычисляется нормированное значение θ и коэффициенты квадратного уравнения
A = θ 2 + n 1 θ + n 2 ; {\displaystyle A=\theta ^{2}+n_{1}\theta +n_{2};} B = n 3 θ 2 + n 4 θ + n 5 ; {\displaystyle B=n_{3}\theta ^{2}+n_{4}\theta +n_{5};} C = n 6 θ 2 + n 7 θ + n 8 , {\displaystyle C=n_{6}\theta ^{2}+n_{7}\theta +n_{8},}после чего находится значение β
β = − B − B 2 − 4 A C 2 A {\displaystyle \beta ={\frac {-B-{\sqrt {B^{2}-4AC}}}{2A}}}и абсолютное значение давления:
P = P 0 β 4 . {\displaystyle P=P_{0}\beta ^{4}.}Давление насыщенного водяного пара (кПа) при различных температурах
| T °C | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | 0,6112 | 0,6571 | 0,7060 | 0,7581 | 0,8135 | 0,8726 | 0,9354 | 1,002 | 1,073 | 1,148 |
| 10 | 1,228 | 1,313 | 1,403 | 1,498 | 1,599 | 1,706 | 1,819 | 1,938 | 2,065 | 2,198 |
| 20 | 2,339 | 2,488 | 2,645 | 2,811 | 2,986 | 3,170 | 3,364 | 3,568 | 3,783 | 4,009 |
| 30 | 4,247 | 4,497 | 4,759 | 5,035 | 5,325 | 5,629 | 5,947 | 6,282 | 6,632 | 7,000 |
| 40 | 7,384 | 7,787 | 8,209 | 8,650 | 9,112 | 9,594 | 10,10 | 10,63 | 11,18 | 11,75 |
| 50 | 12,35 | 12,98 | 13,63 | 14,31 | 15,02 | 15,76 | 16,53 | 17,33 | 18,17 | 19,04 |
| 60 | 19,95 | 20,89 | 21,87 | 22,88 | 23,94 | 25,04 | 26,18 | 27,37 | 28,60 | 29,88 |
| 70 | 31,20 | 32,57 | 34,00 | 35,48 | 37,01 | 38,60 | 40,24 | 41,94 | 43,70 | 45,53 |
| 80 | 47,41 | 49,37 | 51,39 | 53,48 | 55,64 | 57,87 | 60,17 | 62,56 | 65,02 | 67,56 |
| 90 | 70,18 | 72,89 | 75,68 | 78,57 | 81,54 | 84,61 | 87,77 | 91,03 | 94,39 | 97,85 |
| 100 | 101,4 |
См. также
Ссылки
- IAPWS . Сайт Международной ассоциации по изучению свойств воды.
, , , , 21 , , , , 25-26 /2003
§ 5.5. Вода и диаграмма состояния воды
(продолжение)
В физической химии одним из важнейших и очень
сложных с точки зрения вывода является закон
равновесия фаз, который также называется правилом
фаз Гиббса
. Мы только познакомимся с этим
правилом на примере фазовых состояний воды.
На любом поле диаграммы состояния воды (рис. 5.11)
поставьте точку, соответствующую некоторым
температуре и давлению. Проведите из этой точки
горизонтальную прямую в виде стрелки до
пересечения с кривой диаграммы. Если изменять
температуру, двигаясь по этой стрелке, то
существующая фаза не изменится (пока не будет
пересечена кривая).
Рис. 5.11.
|
Теперь такую же прямую в виде стрелки
из той же точки проведите в вертикальном
направлении. Передвижение вдоль этой прямой (при
постоянной температуре) соответствует изменению
давления, которое не приводит к исчезновению
данной фазы и появлению другой.
Из той же точки (или любой другой того же поля)
можно провести прямую, направленную под любым
углом к осям координат. Передвижение вдоль такой
прямой до ее пересечения с кривой диаграммы
состояния означает возможность одновременного
изменения температуры и давления при условии
существования фазы данного поля. Таким образом,
на поле можно одновременно изменять температуру
и давление, не изменяя вида и числа фаз. Мы
говорим, что на поле система имеет две степени
свободы, по числу условий (температура и
давление), которые можно варьировать, не изменяя
вида и числа фаз или льда, или жидкости, или пара.
Число степеней свободы С – это число условий,
которые можно изменять в определенных пределах
без изменения числа и вида фаз.
Вы нагреваете воду от комнатной температуры,
предположим, до 80 °С в разные дни, когда
давление изменяется, но жидкость остается
жидкостью, хотя одновременно изменяются и
температура, и давление. В этих условиях система
имеет две степени свободы, т. е. С = 2.
Теперь поставьте точку, например, на кривой
диаграммы состояния равновесия между жидкостью
и паром (см. рис. 5.11). Жидкая вода и пар могут
находиться в равновесии при некоторых различных
температурах и давлениях, но каждой температуре
отвечает строго определенное давление, и,
наоборот, каждому давлению соответствует строго
определенная температура, при которой
сосуществуют две фазы. В этом случае мы говорим,
что система обладает одной степенью свободы, т. е.
С = 1.
Теперь остановимся на тройной точке О, в которой
при строго определенных температуре и давлении
сосуществуют в равновесии три фазы – лед,
жидкость и пар. Тройная точка характеризуется
единственным сочетанием температуры и давления,
поэтому-то температуру тройной точки и выбрали
как начало отсчета абсолютной температуры в
градусах Кельвина (273,16 К). Стоит незначительно
изменить давление или температуру, как одна из
фаз или сразу две переходят в другую, и система
становится двух- или однофазной – мы попадаем на
соответствующую кривую или поле. Одним словом, в
тройной точке система не имеет ни одной степени
свободы, т. е. С = 0.
При исследовании фазового состояния систем (не
только воды!) знание числа степеней свободы при
данных условиях очень важно, т. к. позволяет
предсказывать, сколько условий равновесия можно
изменять, не боясь появления новых фаз или
исчезновения имеющихся.
Число степеней свободы С равновесной
термодинамической системы подсчитывается по
правилу фаз Гиббса и равно числу компонентов
системы К минус число фаз Ф плюс число факторов n
,
влияющих на равновесие:
С = К – Ф + n .
Здесь дана та формулировка правила фаз Гиббса,
которая приводится в строгой научной физической
или химической литературе, поэтому, наверное,
следует объяснить некоторые термины.
Компоненты системы
– это те ее
составные части, которые могут быть выделены из
системы и могут существовать в индивидуальном
виде. Вода – компонент системы, но ионы воды или
другие ионы в водном растворе не считаются
компонентами, т. к. не могут быть выделены и не
существуют индивидуально. Чистая вода –
однокомпонентная система.
Если мы приготовим раствор поваренной соли NaCl в
воде, то система будет состоять из воды Н 2 О,
ионов натрия Na + и хлорид-ионов Cl – (и,
конечно, ионов водорода Н + и
гидроксид-ионов ОН – , образующихся в крайне
незначительном количестве при диссоциации воды).
Но система будет двухкомпонентной [Н 2 О + NaCl],
т. к. индивидуально можно выделить из раствора
жидкую воду и кристаллический хлорид натрия NaCl.
Факторы, влияющие на равновесие
, –
это то, что мы называли раньше условиями
существования системы. Для рассмотренной
диаграммы состояния воды два фактора влияют на
образование и существование фаз – температура и
давление, n
= 2. Формула правила фаз в этом
случае имеет вид:
С = К – Ф + 2.
В большинстве случаев в лабораторной работе проводят эксперименты при постоянном (атмосферном) давлении, поэтому только температура будет играть роль фактора, влияющего на равновесие, т. е. n = 1. Формула правила фаз в этом случае такова:
С = К – Ф + 1.
В последнее время обнаружено влияние
электромагнитного и гравитационного полей и
многих других факторов на равновесие. Но в
обычной научной работе эти факторы не
учитываются.
Сейчас выполним следующий мысленный
эксперимент, хотя его очень просто проделать
реально. Откройте страницу учебника с диаграммой
состояния воды, выберите на поле льда диаграммы
любую точку, расположенную выше тройной точки и
ниже критической точки. Опыт проводим при
постоянном давлении, поэтому число факторов n
= 1. Число степеней свободы подсчитываем по
формуле
С = К – Ф + 1.
Нагревание при постоянном давлении на диаграмме состояния выражается передвижением по горизонтальной прямой вправо, в сторону поля жидкости. Эта прямая до пересечения с кривой описывает однофазную однокомпонентную систему с числом степеней свободы:
С = 1 – 1 + 1 = 1.
Это означает, что, изменяя температуру, мы
сохраняем ту же фазу в системе, и она продолжает
оставаться льдом до тех пор, пока прямая не
пересечет кривую зависимости температуры
плавления льда от давления.
Теперь для представления результатов
эксперимента построим график «время –
температура» (рис. 5.12). Пока мы, повышая
температуру, продвигаемся по полю льда, он
нагревается, но не плавится. На этом графике
повышение температуры льда представлено прямой а
,
поднимающейся кверху.
Одновременно следите по диаграмме состояния
воды (см. рис. 5.11) за продвижением вдоль прямой по
полю льда к полю жидкой воды. Наконец температура
льда достигла значения на кривой зависимости
температуры плавления от давления. Тогда лед
начинает плавиться, и система становится
двухфазной (лед и жидкость). Число степеней
свободы, относящееся к любой точке этой кривой,
равно:
С = 1 – 2 + 1 = 0.
Здесь система не имеет степеней свободы! Это означает, что, сколько бы тепла ни подводили к смеси воды и льда, температура ее будет оставаться постоянной (0 °С), пока в жидкости будет находиться хоть мельчайший кусочек льда. На графике «время – температура» (см. рис. 5.12) плавление льда представлено горизонтальной прямой б , т. к. система не имеет степеней свободы.
В научной литературе такая
горизонтальная линия называется площадкой, она
указывает на постоянство температуры в системе и
отсутствие степеней свободы. Теперь вам понятно,
почему смесь льда и воды нельзя нагреть выше
0 °С?
Наконец весь лед превратился в жидкую воду.
Подводимая в систему теплота расходуется теперь
на нагревание воды. Снова обратитесь к диаграмме
состояния воды. Сейчас мы находимся на поле
жидкой воды и продвигаемся с повышением ее
температуры в сторону поля газа. На графике
«время – температура» появляется прямая в
,
поднимающаяся кверху, т. к. температура жидкости
повышается. Это разрешает правило фаз, т. к.
однофазная система имеет одну степень свободы:
С = 1 – 1 + 1 = 1.
Температура системы поднялась до значения, отвечающего пересечению горизонтальной прямой на диаграмме состояния с кривой зависимости давления пара воды от температуры. Началось кипение воды. Система стала двухфазной, с числом степеней свободы снова равным нулю:
С = 1 – 2 + 1 = 0.
На графике «время – температура» появится
горизонтальный участок г
, т. е. новая
площадка, и температура 100 °С будет постоянной
до тех пор, пока не испарится (выкипит) последняя
капля жидкости.
Жидкая вода полностью перешла в газ. Подводимая
теплота расходуется на нагревание газообразной
воды. Мы продвигаемся на диаграмме состояния
воды (см. рис. 5.11) по полю газа. Система имеет одну
степень свободы, что на графике отражено
поднимающейся кверху прямой д
(см. рис. 5.12).
Если вы поняли, что такое диаграмма состояния, и
увидели, как применяется правило фаз Гиббса, то
самостоятельно сможете разобраться в таких
диаграммах состояния, как, например, «золото –
медь», «золото – серебро» и других более сложных,
которые помогут ответить на вопрос о составах
разнообразных сплавов.
Список новых и забытых понятий и слов